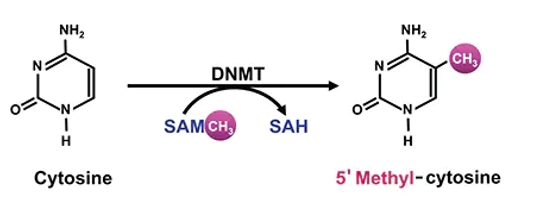
DNA甲基化是一种重要的表观遗传学修饰形式,指的是DNA分子上附加甲基基团(-CH3)的过程。在甲基化的过程中,甲基基团通常被共价地添加到DNA分子的胞嘧啶(Cytosine,简称C)碱基上,形成5-甲基胞嘧啶(5-methylcytosine,5mC)。甲基化通常发生在DNA的CpG位点上,即DNA序列中的胞嘧啶和鸟嘌呤(Guanine,简称G)之间的连接处。甲基化是一种稳定的DNA修饰形式,可以影响基因表达、基因组稳定性、细胞分化和发育等生物学过程。
甲基化在基因组中起着重要的调控作用,包括抑制基因的转录、维持基因组稳定性、调节染色体结构和功能等。甲基化的模式和水平在不同细胞类型、组织和生理状态下会有所不同,而异常的甲基化状态与多种疾病的发生和发展密切相关,如癌症、神经系统疾病、心血管疾病等。因此,甲基化在生物学研究和医学领域中具有重要的意义。
除此之外,甲基化在动植物领域也有着广泛的应用,比如通过研究动植物基因组中的甲基化模式和分布,可以揭示甲基化在生长发育、环境适应等过程中的调控机制;通过对不同物种种质资源的甲基化状态进行分析,可以为动植物遗传改良和种质资源保护提供重要的信息;研究甲基化在植物与病原体相互作用中的调控机制,揭示植物抗病性的分子机制等等。总的来说,甲基化在动植物领域的应用涵盖了基因表达调控、种质资源保护、遗传改良、抗病性研究和生物技术等多个方面。
随着技术的不断发展,检测甲基化的技术也逐步多样化。比如,利用重亚硫酸盐(Bisulfite)转化建库测序,得到单碱基分辨率甲基化位点的全基因组甲基化测序WGBS;利用限制性内切酶Mspl对基因组进行酶切富集,选择启动子及CpG岛等关键区域进行测序的简化甲基化测序RRBS;利用抗体富集获得关注甲基化类型的DNA免疫共沉淀测序技术MeDIP等等。根据不同的需求结合自身预算,利用这些技术都可以帮助我们找到甲基化的区域。
那么怎样设计课题才能帮助我们解决甲基化带来的生物学问题呢?接下来我们一起来看几篇已发表的文章,重点关注文献中的课题设计部分,希望能给大家带来启发。
「 不同品种比较 」
DNA甲基化对动植物的育种、生长发育、疾病抗性等方面起到了重要的调控作用。不同的样本普遍存在DNA甲基化的差异,针对同一物种的不同品种进行研究,有助于我们从表观遗传变异的角度发现新的遗传资源,为培育更优良的农作物品种提供新思路。
植物——番茄
2023年3月发表在《Science China Life Sciences》 (IF=10.372)杂志的“Population analysis reveals the roles of DNA methylation in tomato domestication and metabolic diversity”通过对野生品种、地方品种和栽培品种的番茄群体进行WGBS、RNA-seq和代谢组学等分析,解析了番茄群体代谢多样性与育种过程中DNA甲基化变化的关系,构建了多组学关联网络并完善了番茄多酚等代谢物的合成通路。

样本选取野生品种(S.pimpinellifolium)、地方品种(S.lycopersicum var cerasiforme)、栽培品种(S.lycopersicum)共96份不同品种番茄样本,每个品种至少20株。利用WGBS测序数据总共产生了约96.6亿个reads,平均测序深度超过32×。这些reads与每个校正后的伪参考基因组进行比对,平均比对率为79.9%。CG、CHG和CHH的全基因组平均胞嘧啶甲基化水平分别为72.79%、45.64%和7.82%。后续结合差异甲基化区域(DMR)的筛选和不同样本间的比较,发现番茄育种过程中DMR的数量、长度和信号水平逐渐下降,说明番茄在驯化和改良过程中发生了很大的变化。
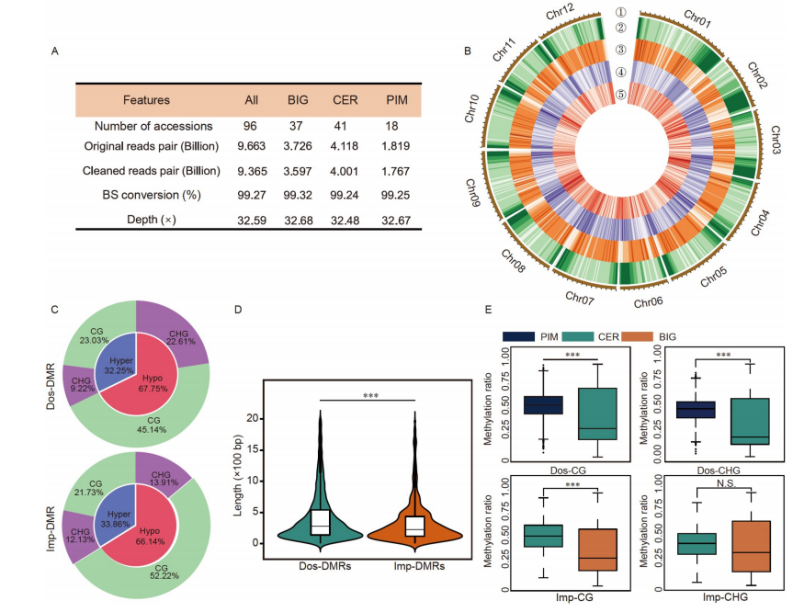
不同番茄品种的DNA甲基化图谱
文章亮点在于作者收集了来自世界不同区域的番茄材料的DNA甲基化组、转录组和代谢组。通过检测全基因组的DMRs,研究了DMR与选择清除以及SNP的关系。并且通过mGWAS和EWAS验证了13个基因,发现SNP和DMRs不仅独立而且协同影响候选基因的表达。这些发现表明DNA甲基化变异可能是人类选择的结果,并且大部分DMRs不被SNP标记,暗示了DNA甲基化变异的对未来育种的重要指导意义。
动物——牛
2023年05月,发表在《Genome Biology》杂志的题为“Profiling the immune epigenome across global cattle breeds”的研究论文,通过使用简化甲基化测序(RRBS)、ATAC-seq、RNA-seq对Holstein Friesian(欧洲taurine)、N’Dama(非洲taurine)和Nelore(印度indicine)三个不同牛品种的七种类型的免疫细胞进行了DNA甲基化、染色质可及性和RNA表达谱构建。

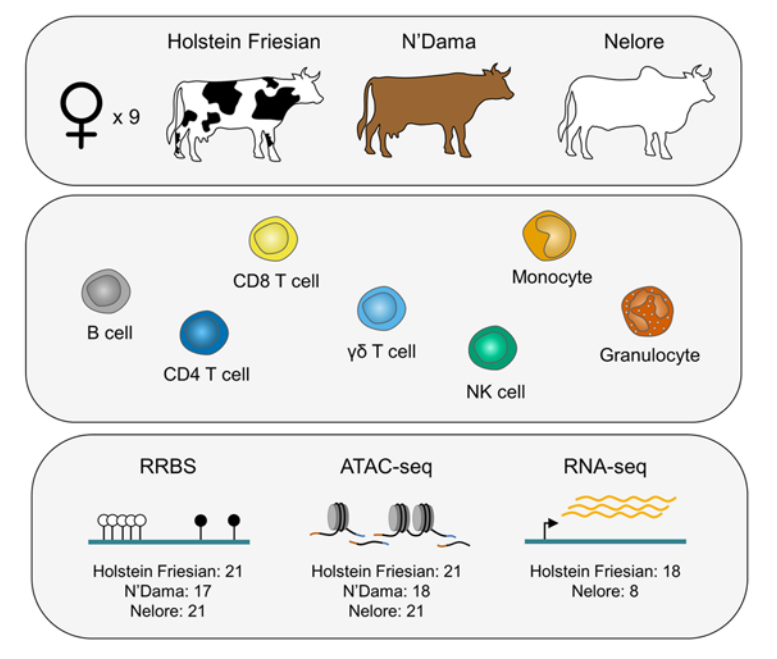
RRBS、ATAC-seq和RNA-seq建库测序,得到一共150多个与免疫相关的多组学数据,研究三个不同牛谱系中牛免疫系统的DNA甲基化和染色质可及性变化。研究结果表明发现taurine牛和indicine牛在免疫细胞类型上存在广泛的表观遗传差异,这与两个牛谱系之间的局部DNA序列差异水平有关。特异性细胞类型谱能够使用数字细胞术对复杂的细胞混合物进行反卷积。最后,根据CpG岛的染色质和甲基化谱分析了CpG岛的不同亚群类别,这些亚群区分了与离散转录状态相关的远端岛和基因近端岛。
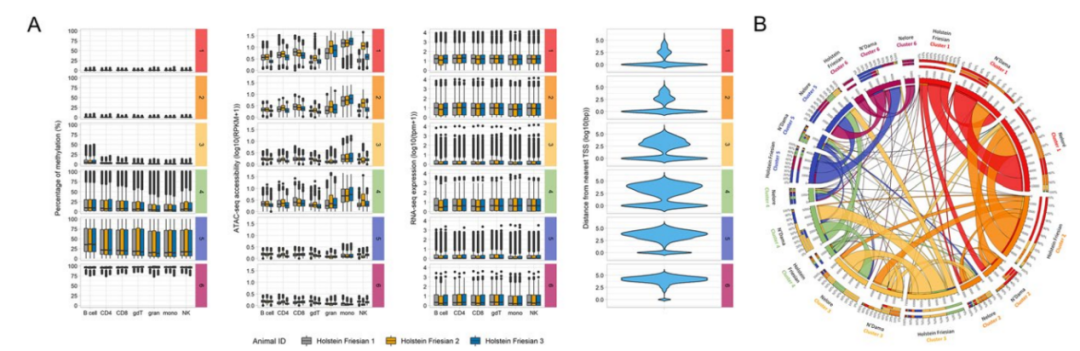
CGI的无监督聚类分析鉴定出不同的染色质景观
研究数据将有助于鉴定不同细胞类型、不同牛品种和物种的保守或不同的表观遗传模式和调控机制。有利于理解进化谱系中表型变异的遗传基础,加速牛的遗传改良计划,以培育具有更强大免疫系统的动物。
「 不同发育阶段比较 」
在物种的发育过程中,甲基化程度是动态变化的。在胚胎发育的早期阶段,甲基化程度较低,而在后续发育阶段会逐渐增加。这种动态变化的甲基化程度调控了基因的表达,帮助物种完成不同发育阶段所需的基因表达模式。此外,甲基化还可以通过调节基因的表达水平来影响物种的发育过程。过高或过低的甲基化程度都可能导致基因表达异常,进而影响物种的正常发育。因此,研究甲基化在发育过程中的作用对于理解物种发育的机制具有重要意义。
植物——梨果实
2024年3月,发表在《Genome Biology》杂志上的“Multi-omics provide insights into the regulation of DNA methylation in pear fruit metabolism”的研究论文,利用多组学手段,通过对砀山酥梨果实从果实发育到成熟共11个发育阶段的代谢组、蛋白质组、转录组进行全面分析。通过全生育期数据构建基因-代谢物关联数据库,并进行全基因甲基化检测以及Small RNA-seq,探究DNA甲基化在梨果实发育过程中关键作用,筛选关键转录因子,并进行深入验证。总的来说,该研究为梨果实发育过程中代谢调节网络的表观遗传调控提供新见解。

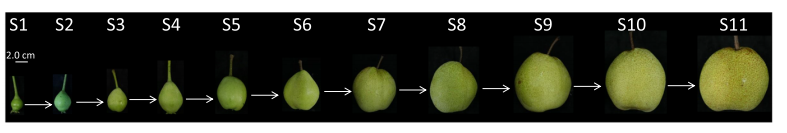
实验共11个取样节点:开花后4周(S1)、6周(S2)、8周(S3)、10周(S4)、12周(S5)、14周(S6)、16周(S7)、18周(S8)、20周(S9)、22周(S10)和24周(S11)。文章通过对不同发育阶段的甲基化水平比较,发现在发育过程中DNA甲基化水平在全基因组和CHH甲基化类型逐渐升高,在CG甲基化类型逐渐降低,CHG甲基化类型几乎没有变化。除了基因体内胞嘧啶甲基化水平逐渐下降外,在基因体及其侧翼区域也观察到这些趋势。此外,CG甲基化水平转座因子(TE)的两个侧翼区域甲基化水平逐渐降低,而TE小体及其侧翼区域CHH甲基化水平逐渐升高。结果表明,DNA甲基化的增加主要是由CHH甲基化的升高引起的。
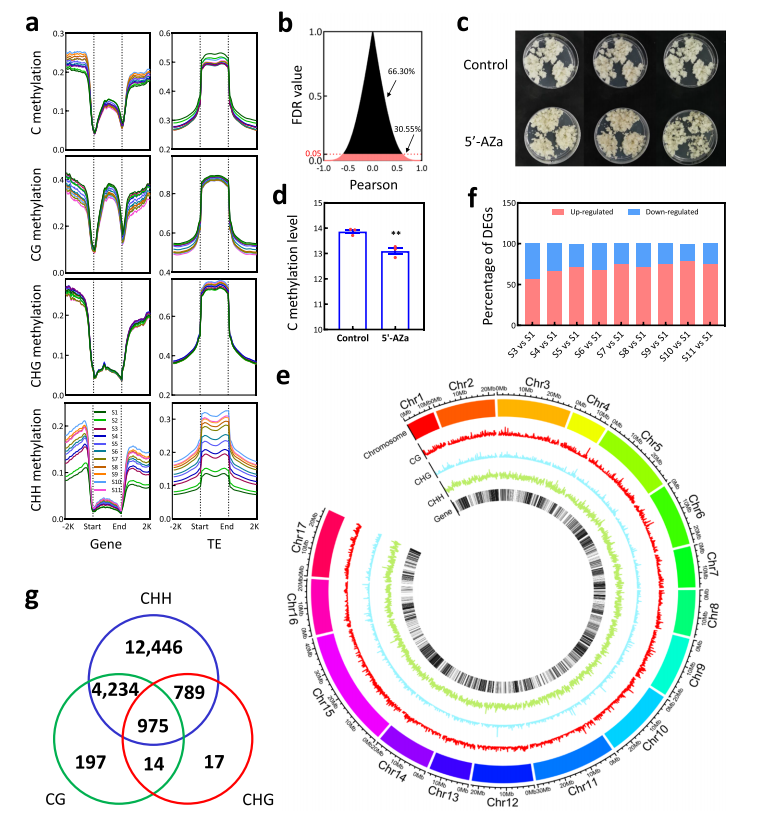
梨果实发育过程中DNA甲基化参与基因转录
动物——泥鳅
2023年02月,发表在《International Journal of Biological Macromolecules》 (IF=8.025)杂志的题为“DNA methylation mediates gonadal development via regulating the expression levels of cyp19a1a in loach Misgurnus anguillicaudatus”的研究论文,该文主要研究泥鳅(Misgurnus anguillicaudatus)中芳香化酶基因cyp19a1a和cyp19a1b在性腺发育过程中的表达和DNA甲基化水平变化,揭示了DNA甲基化通过环磷酸腺苷(cAMP)依赖途径调节卵巢中cyp19a1a基因表达,从而影响性腺发育的机制。

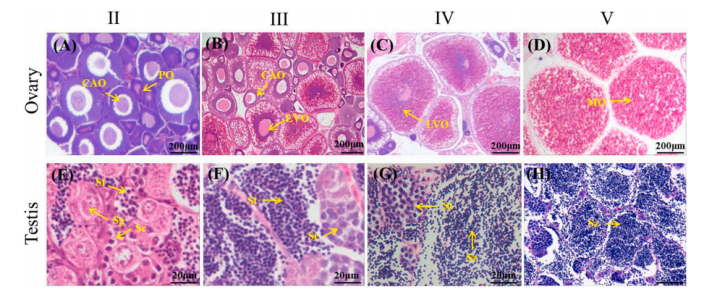
文章用亚硫酸盐修饰测序法分析了两个基因启动子区域和第一外显子区域的DNA甲基化水平,并探讨了DNA甲基化与基因表达水平之间的相关性。构建了泥鳅生殖腺(卵巢、精巢)发育阶段cyp19a1a的DNA甲基化谱,确定四个性腺阶段(II,III,IV和V)的DNA甲基化水平。通过研究泥鳅中芳香化酶基因cyp19a1a和cyp19a1b在性腺发育过程中的表达和DNA甲基化水平变化,揭示了DNA甲基化通过cAMP依赖途径调节卵巢中cyp19a1a基因表达,从而影响性腺发育的机制。与卵巢相比,cyp19a1a在精巢中表达较低,且高甲基化。
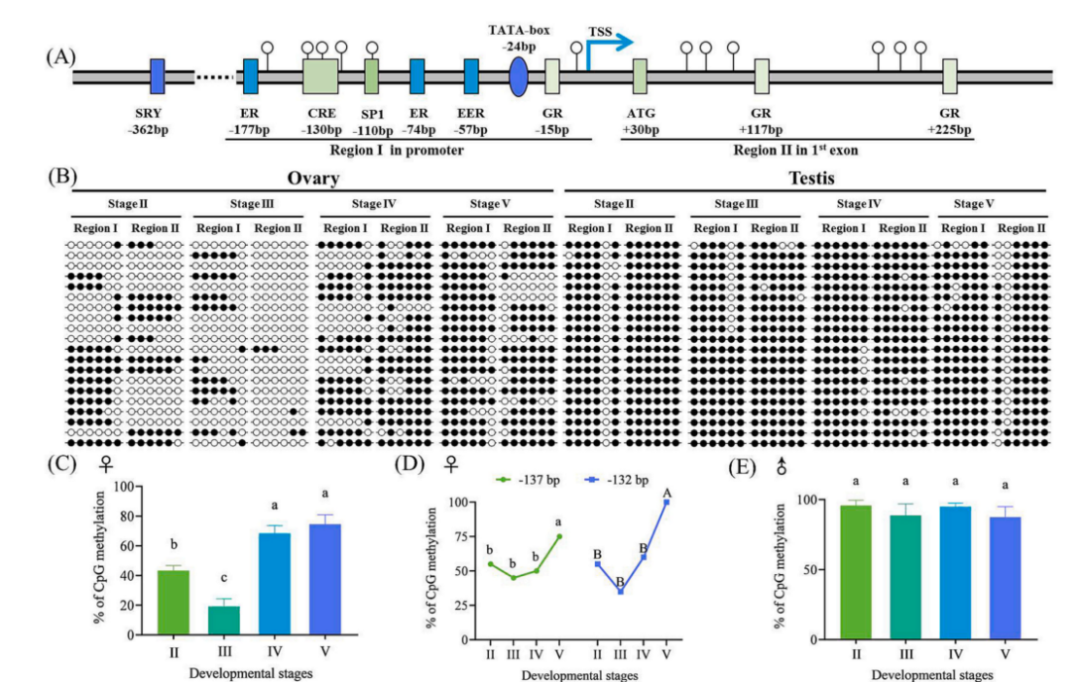
泥鳅生殖腺发育阶段cyp19a1a的DNA甲基化谱
证明了cyp19a1a和cyp19a1b在泥鳅中的表达具有组织和性别特异性,且随着性腺发育阶段而变化。DNA甲基化通过cAMP依赖途径在泥鳅及其他低等脊椎动物性腺分化和发育过程中及在建立性腺cyp19a1a的时空表达模式中发挥关键作用。
「 胁迫处理 」
甲基化程度与胁迫之间存在着复杂的关系。在植物和动物中,环境因素的胁迫可以引起基因的表观遗传修饰,甲基化是其中一个重要的调节机制。
一方面,胁迫可以直接导致甲基化水平的变化。这里的胁迫是指温度变化、盐碱胁迫、干旱等等。甲基化水平的变化会导致基因的表达水平发生调节,从而引起表型的变化。另一方面,甲基化在植物响应胁迫中也扮演着重要角色。当胁迫来临时,会产生类似于“免疫”反应,通过自身的甲基化调节去应对和抵抗外界胁迫的压力。这当中的甲基化程度的变化可能是通过改变胁迫响应途径中的信号转导或基因表达,从而实现适应胁迫并产生抗性。
因此,甲基化程度与胁迫之间的关系是双向的,胁迫条件可以影响甲基化程度,而甲基化程度的变化也可以影响生物对胁迫的反应。研究这种关系有助于深入理解生物对环境胁迫的应对机制。
植物-草莓
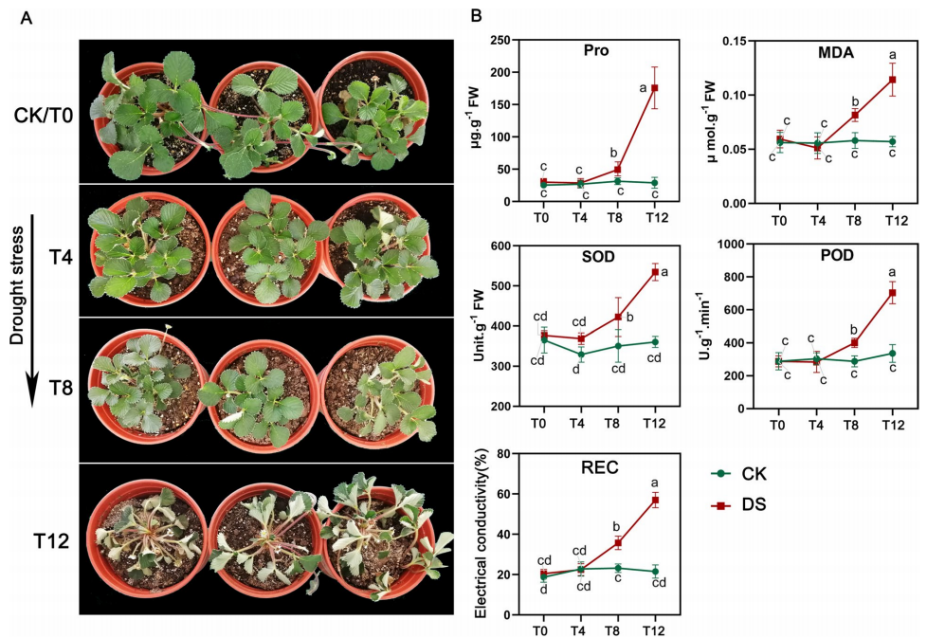
2022年10月,发表在《BMC Plant Biol》(IF=5.26)杂志题为“Integrated transcriptome and methylome analyses reveal the molecular regulation of drought stress in wild strawberry (Fragaria nilgerrensis)”的研究论文,通过对黄毛草莓(F. nilgerrensis)干旱胁迫处理过程中四个干旱时间点的基因表达谱、全基因组DNA甲基化图谱和生理性状的综合分析,研究了黄毛草莓干旱响应的调控网络。

实验设计采用同一克隆的F. nilgerrensis野生草莓作为材料,在温室中进行干旱处理实验,分为对照组(CK)和处理组(DS):CK组每2天浇水一次;DS处理组从0d到12d没有浇水。在持续干旱胁迫处理期间的四个时间点收集F.nilgerrensis叶片:0d(T0,CK),4d(T4),8d(T8)和12d(T12),每组设置三个生物学重复。
通过WGBS技术研究构建了3种干旱处理程度下的DNA甲基化图谱,发现mCG、mCHG和mCHH在总mC位点中的百分比在不同时间点表现出动态变化,其中mCHH不仅占最高百分比,而且表现出最大变化。差异甲基化区域(DMR)主要发生在CHH环境中,其中约80%位于重复元件中,其次是启动子和内含子。在启动子差异甲基化基因(DMG)中,所有时间点有317个低甲基化共有基因和21个高甲基化共有基因,说明这些基因的甲基化水平动态变化,可能直接或间接参与调控表达基因对干旱胁迫的调控。KEGG富集分析结果表明,这些基因主要参与植物激素信号、MAPK信号通路和泛素介导的蛋白水解通路。
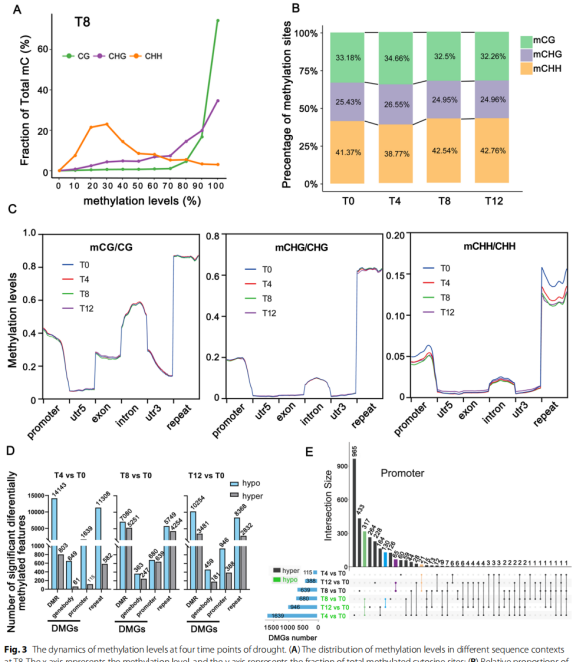
干旱胁迫下四个时间点DNA甲基化水平变化
后续作者又将甲基化的差异基因与转录组差异基因联合分析,加上WGCNA分析与qRT-PCR验证实验,实现了对DNA甲基化、转录组和生理性状的综合分析,体现了DNA甲基化和基因表达之间微妙的相关性(在启动子和基因体中都显示出正相关和负相关),表明DNA甲基化和基因表达之间存在多种类型的关联。
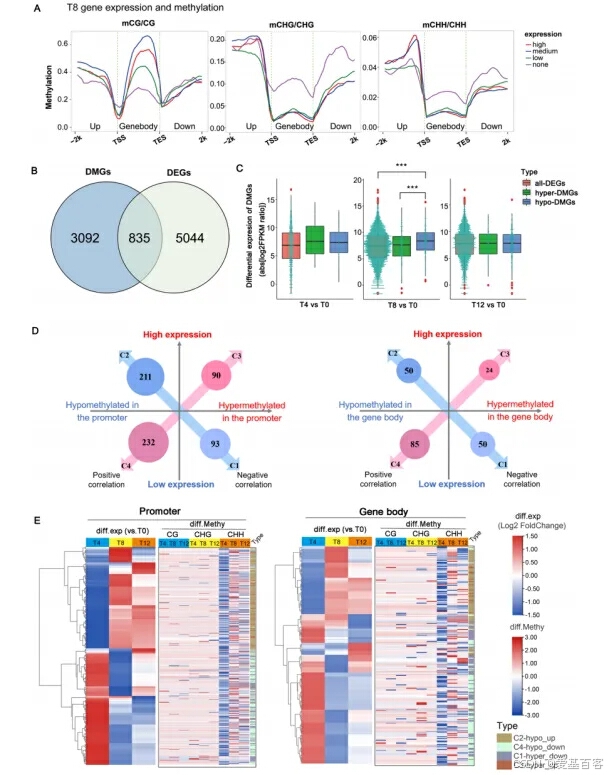
甲基化组和转录组关联分析揭示干旱响应基因的表达调控
本研究通过对DNA甲基化、转录组和生理性状的综合分析,揭示了F.nilgerrensis的干旱响应调控网络。表明了ABA依赖性和非依赖性信号通路在F.nilgerrensis的干旱响应中发挥作用。此外,渗透调控能力和维持ROS再生与清除平衡能力对于预防代谢功能障碍至关重要,且在很大程度上决定了F.nilgerrensis的整体抗旱性。为全面探索植物抗旱机制提供了模型,为育种和作物管理提供了参考。
「 总 结 」
以上我们汇总了不同品种、不同发育阶段(时间线)以及不同胁迫处理的实验设计策略的相关文献。关于这些文献的课题设计可以稍微发散下运用到自己的课题中。
例如不同发育阶段,除了果实以外可以做花朵的发育:从花苗→花蕾→开花→授粉传粉→结实;或者叶片的发育:如小麦从分蘖→拔节→孕穗→抽穗→开花→灌浆的叶片,种子发育也可以类似参考。
不同胁迫处理,常规的植物来说,可以选择盐胁迫、镉胁迫、寒冷胁迫、病原胁迫等等,当然选择什么胁迫处理要考虑到整个大的课题研究方向。动物也可以选择不同的用药处理,通过甲基化的差异比较,探究在面对胁迫时不同药物的药效价值以及药物在体内的调控机制。
有关甲基化更多信息欢迎您的咨询,爱基可以提供WGBS、MeDIP、6mA-IP-seq、LC-MS/MS、Dot Blot、MeRIP等技术。
参考文献
【1】 Guo H, Cao P, Wang C, Lai J, Deng Y, Li C, Hao Y, Wu Z, Chen R, Qiang Q, Fernie AR, Yang J, Wang S. Population analysis reveals the roles of DNA methylation in tomato domestication and metabolic diversity. Sci China Life Sci. 2023 Aug;66(8):1888-1902. doi: 10.1007/s11427-022-2299-5. Epub 2023 Mar 23. PMID: 36971992.
【2】Powell J, Talenti A, Fisch A, et al. Profiling the immune epigenome across global cattle breeds. Genome Biol. 2023;24(1):127. Published 2023 May 22. doi:10.1186/s13059-023-02964-3
【3】Gu C, Pei MS, Guo ZH, et al. Multi-omics provide insights into the regulation of DNA methylation in pear fruit metabolism. Genome Biol. 2024;25(1):70. Published 2024 Mar 14. doi:10.1186/s13059-024-03200-2
【4】Su J, Yi S, Gao Z, Abbas K, Zhou X. DNA methylation mediates gonadal development via regulating the expression levels of cyp19a1a in loach Misgurnus anguillicaudatus. Int J Biol Macromol. 2023;235:123794. doi:10.1016/j.ijbiomac.2023.123794
【5】Cao Q, Huang L, Li J, et al. Integrated transcriptome and methylome analyses reveal the molecular regulation of drought stress in wild strawberry (Fragaria nilgerrensis). BMC Plant Biol. 2022;22(1):613. Published 2022 Dec 28. doi:10.1186/s12870-022-04006-9